主な症状:ふらつき、失神、倦怠感、労作時息切れ
上記のいずれかの症状があれば、脈が遅くなっており、ペースメーカの適応となる可能性があります
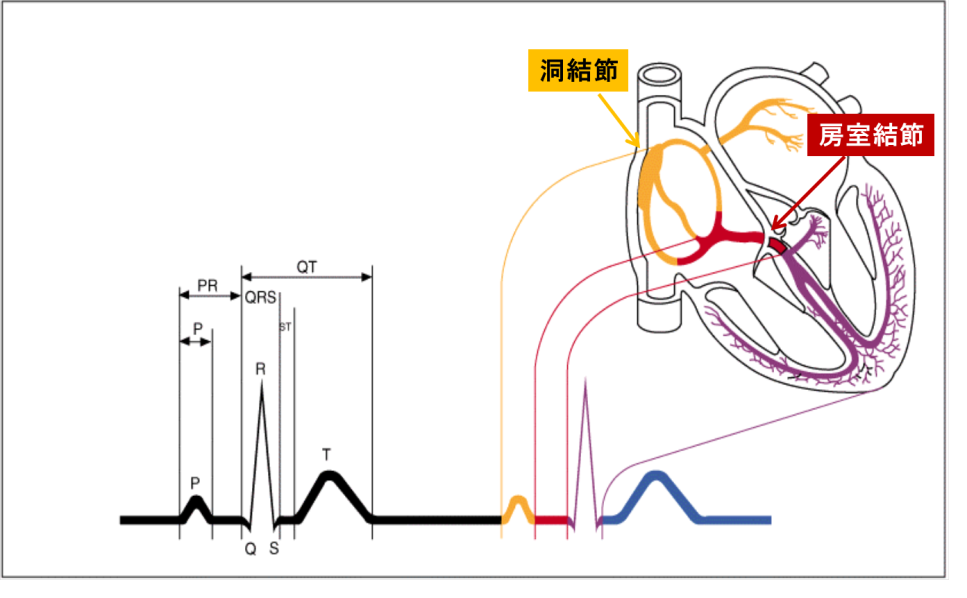
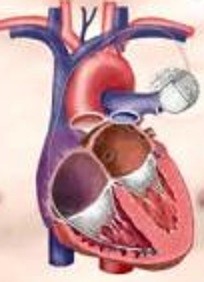
洞結節から生じた電気刺激が心房に伝わり、さらにその刺激が房室結節を通して心室に伝わります。心室に電気刺激が伝わって初めて有効な心収縮が得られます。
自分のペースメーカの役割をしている洞結節の異常
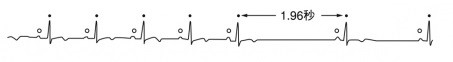


心房と心室を電気的につないでいる房室結節の異常

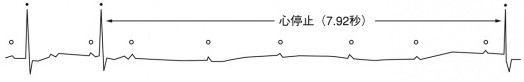
上記の疾患があればペースメーカの適応となります。
心房と心室にそれぞれ1本ずつリードを挿入します。
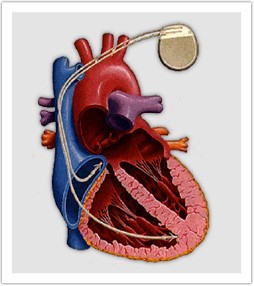
心室に1本リードを挿入します。
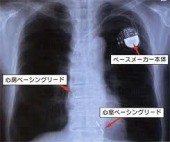
予定入院の場合は植え込み前日に入院していただき、翌日に植え込み手術をします。
手術約1週間後に退院となります。
4~6か月に1度外来で不具合がないかをチェックします。
徐脈性不整脈の治療としては、ペースメーカ治療があります。1930年代に体外式ペースメーカから始まったこの治療方法は電気信号を感知・発信する本体と、心筋と本体をつなぐリード線を長い間必要としておりました。
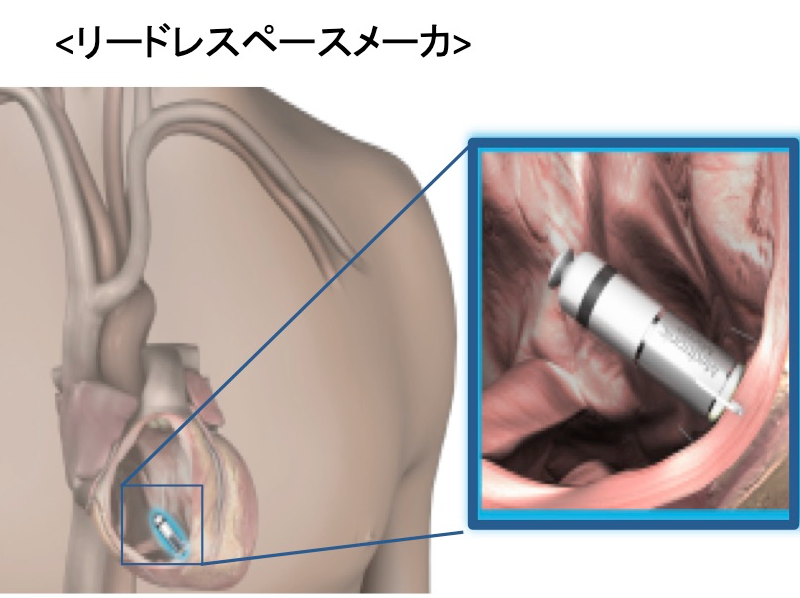
2017年より本邦で使用可能となったリードレスペースメーカ(MicraTM, Medtronic社)は、カプセル型の本体をカテーテルデリバリーシステムにて鼠径部から右心室に留置します。本体に刺激電極が一体化されており、今まで必要としたリード線が不要になりました。本体の体積はわずか1ccであり、重さも1.75gと非常に小さくなっております。さらにMRIにも対応しており、心臓を含む全身の撮像が可能になっております。
本体を心腔内に留置することで胸部に膨らみや傷もなく装置を意識することもありません。リード線断線やポケット感染の合併症も気にする必要がありません。静脈アクセスルートの閉塞など今まで開胸的に心筋リードを植え込むしかなかった症例には、開胸手術なくペースメーカ留置可能となります。
しかし、このデバイスにも問題点はあります。フックをかけて心筋に固定するシステムであるため心筋の薄い心房には留置できず、心房刺激はできません。そのため心室シングルチャンバーペースメーカの適応の患者さまにのみとなります。
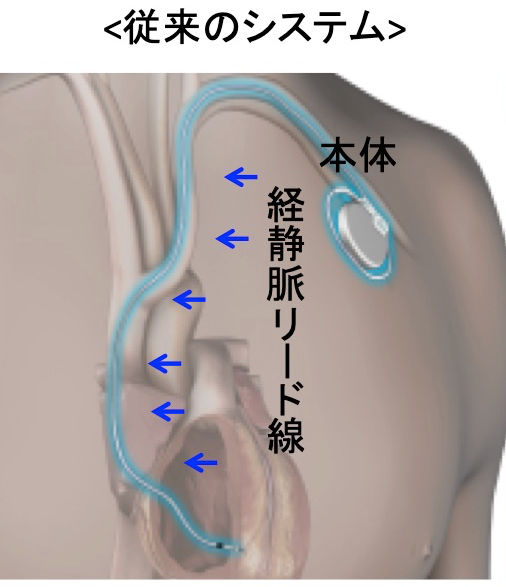

今までは心室をペーシングするには心筋に直接電気刺激を行うしか方法はなく、通常の生理的な電気興奮パターンとは違うため非生理的とされ、心室ペーシング率が増加すると心機能が徐々に低下する症例が少数ながら存在し、心不全入院が多くなるという報告がありました。
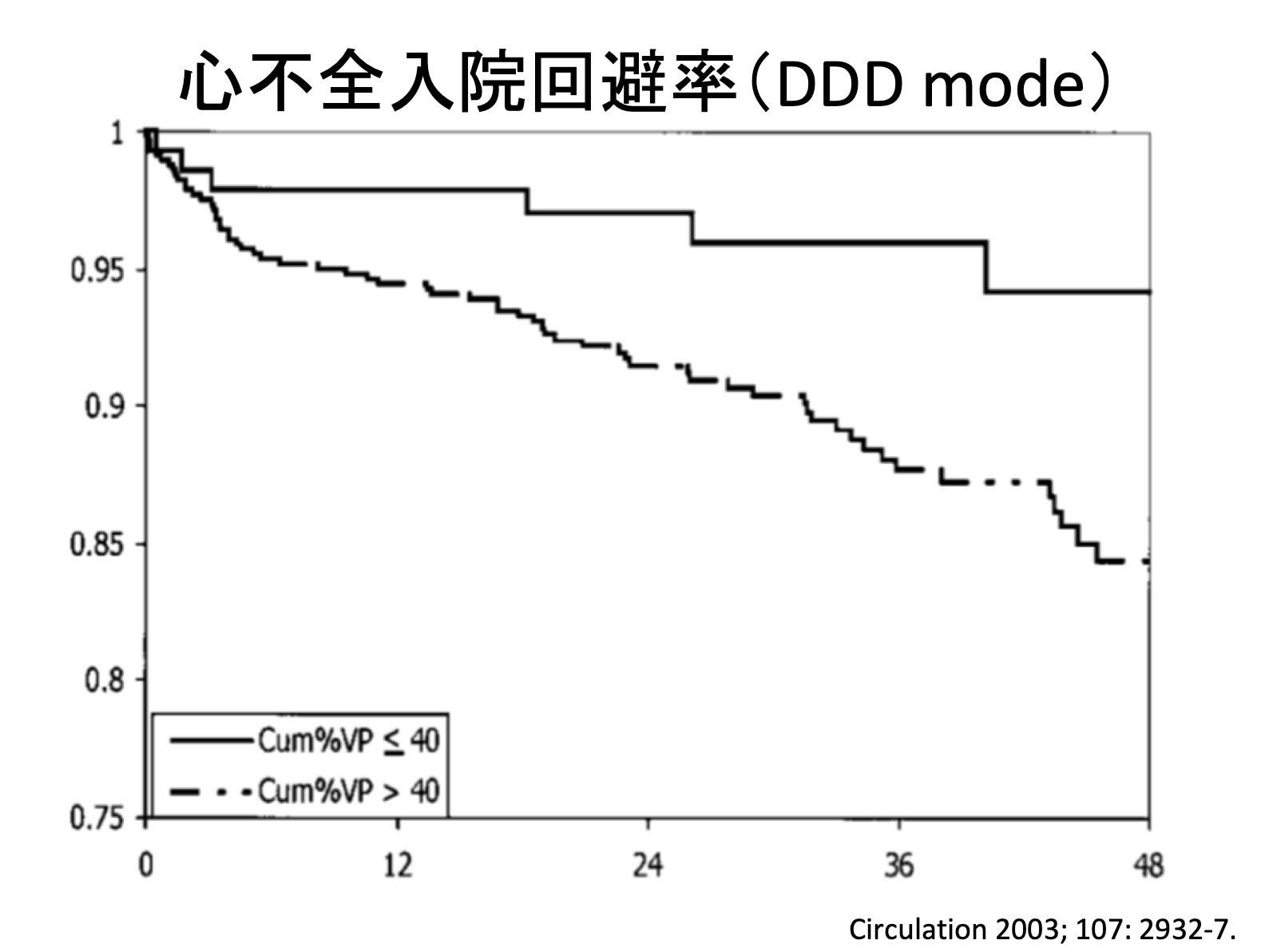
右室心尖部ペーシングに比べて右室中隔ペーシングの方が生理的とされてきましたが、心不全回避や心機能低下を防ぐ明確なエビデンスはありませんでした。
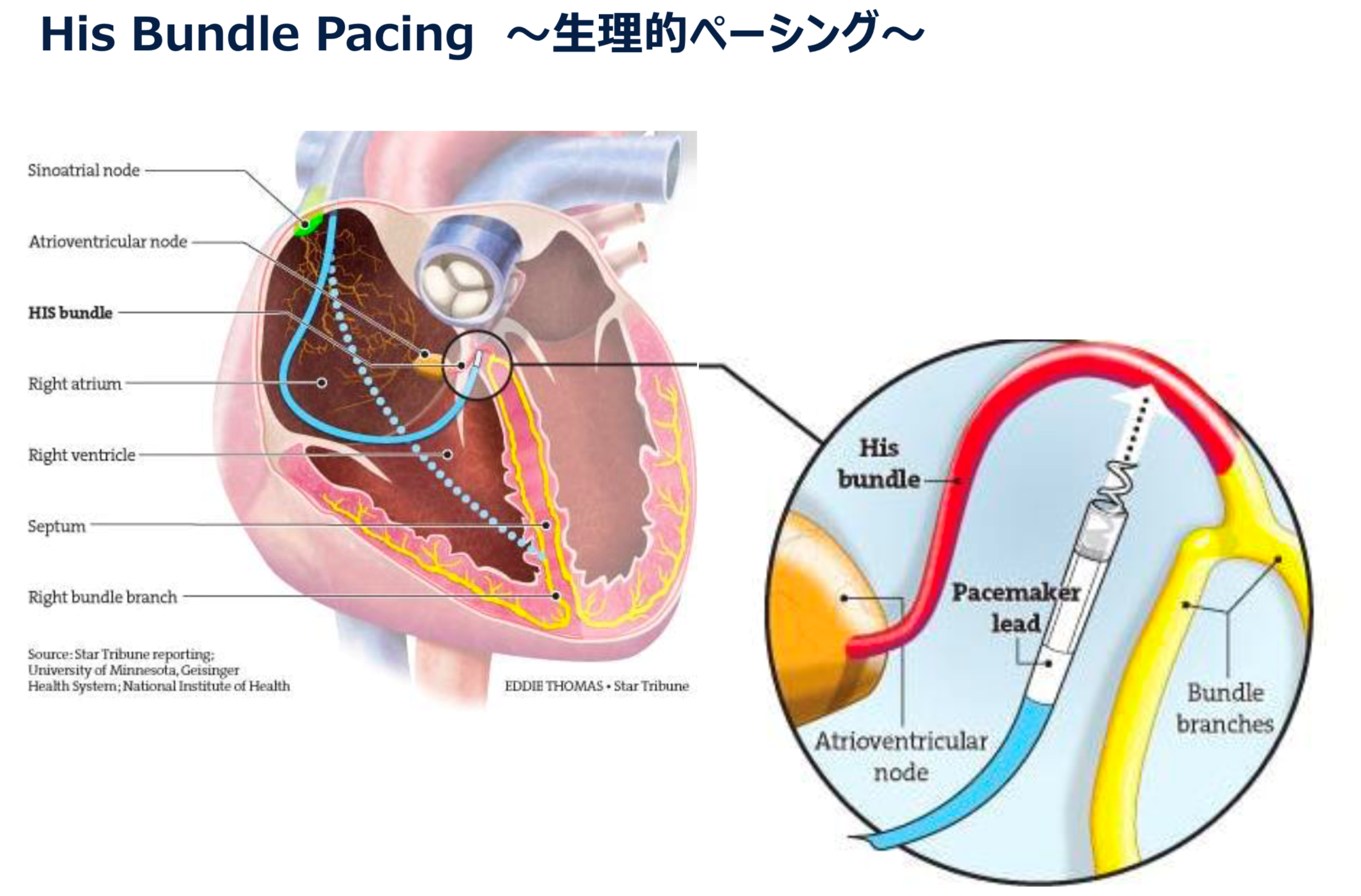
そこで本来の刺激伝導系を利用したHis束ペーシングシステムが開発され当院でも施行可能となっております。
ただし、全例で施行可能なわけではなくHis束そのものが障害されている症例や、ペーシング閾値の問題から通常の右室ペーシングに移行せざるおえない症例も少なくないと報告されております。
ICDとは、心室頻拍、心室細動といった致死性不整脈を自動的に感知し、発作に反応して電気ショックを発動させ不整脈による突然死を防ぐことができるデバイスです。致死性不整脈のリスクがある患者さま、もしくはそれらを過去に起こしたことのある患者さまがICDの植え込みの対象となります。どのような患者さまに致死性不整脈のリスクがあるかというと、心機能が高度に低下した患者さま、もしくはブルガタ症候群やQT延長症候群などの若年突然死を招く心電図波形の患者さまがそれに該当します。
ICDは大きく分けると2種類あります。一つはペースメーカーと同じで静脈から心臓内に電線(リード)を留置する経静脈ICD、もう一つは心臓にはリードを入れず、皮下にのみリードを留置する、完全皮下植え込み型除細動器(S-ICD)です。当院ではいずれの治療もすることができます。どちらを選択するかは、患者さまの心臓の機能やリスクによって判断をします。
ICDを植え込んだ患者さまは、手術から一定の期間、自動車運転の制限があります。ある一定期間を過ぎ、警察署届出をすれば運転の再開は可能となりますが、再開後もICDが作動すれば、再度一定期間、運転禁止となります。
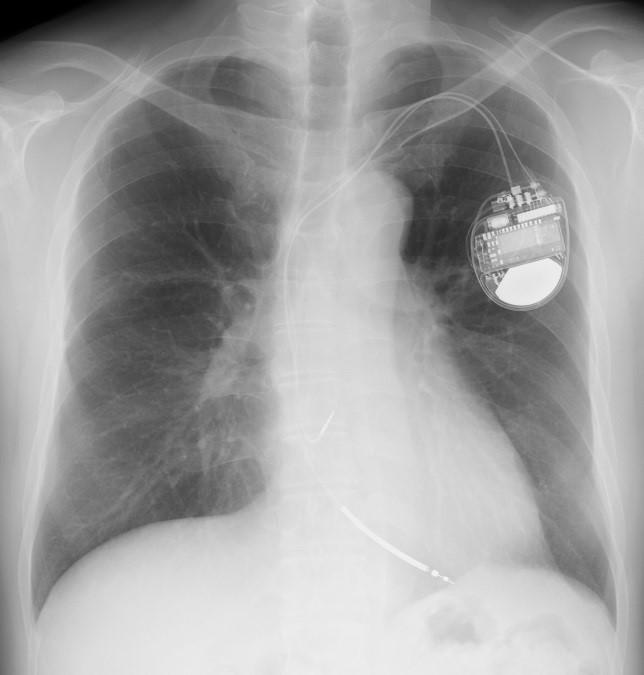

図1:経静脈ICD
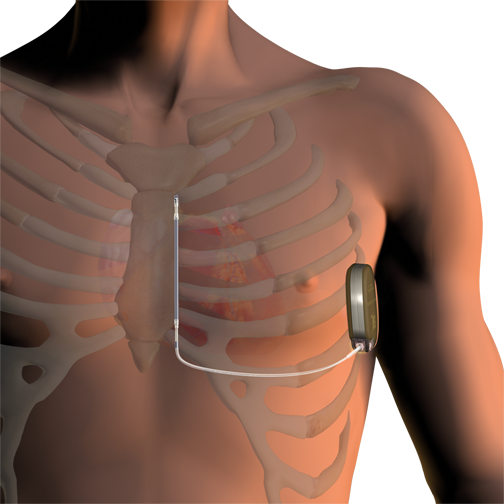

図2:完全皮下植え込み型除細動器(S-ICD)
心臓の収縮の際に心臓全体が同じタイミングで動いていないことで、心臓の機能が低下をする場合があります。そういった患者さまに対しペースメーカーを植えこむことで、心臓の収縮のタイミングを一致させ、心臓の機能を回復させる治療のことを心臓再同期療法(CRT)といいます。心臓の収縮機能が低下をしており息切れや浮腫などといった心不全の症状ある患者さまのうち、心電図波形で心臓の収縮のタイミングがずれていると判断される患者さまが、この治療の対象となります。
ペースメーカーの電極を右心室と、冠静脈洞という心臓の外側を走る血管を介して左心室へと留置をします。そこで、どのようなタイミングで右心室と左心室の電極から刺激を送るかをペースメーカーが計算して、最適なタイミングで刺激をすることで、心臓の興奮のタイミングをより正常に近いものへと改善することができます。CRTを植え込むことで、心不全患者さまの再入院を予防するエビデンスがいくつかでてきています。しかし、中にはCRTの効果が乏しい患者さまもいることは事実であり、どのような患者さまを選択するかどうかが非常に重要となってきます。
CRTにも大きく分けると2種類あります。一つはペーシング機能のみのもの(CRT-P)、もう一つはペーシング機能に加え上記のようなICD機能も備わったもの(CRT-D)です。どちらを選択するかは年齢や背景にある疾患によって判断をします。
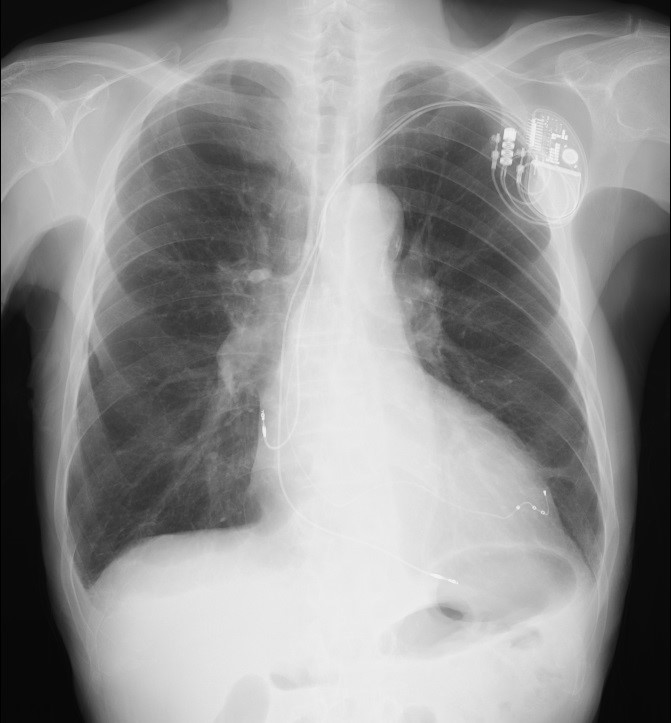
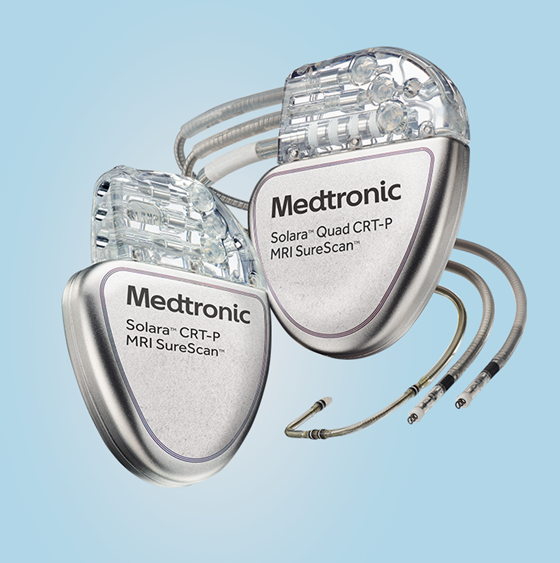
図1:CRT-P
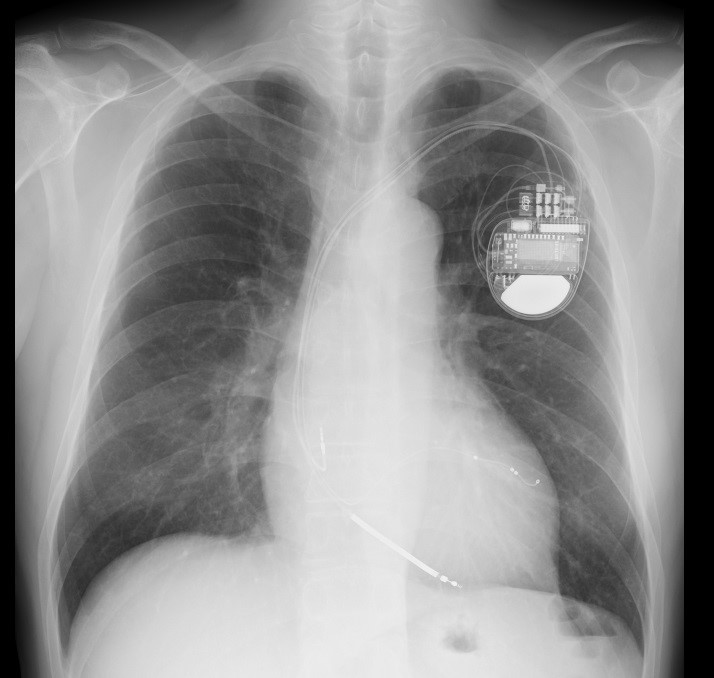
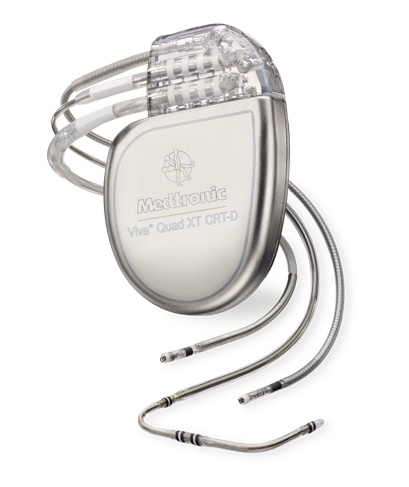
図2:CRT-D
不整脈はその性質上、発作時の心電図を捉えないと診断がつかないという問題があり、24時間ホルター心電図や携帯型心電計などの検査が行われております。しかしこれらの検査も施行可能時間の制限があり不整脈の評価としては十分でないこともあります。
植え込み型ループレコーダーは、左胸の皮下に挿入することで約3年間心拍動を持続的にモニターし、徐脈性や頻脈性の不整脈の有無を評価することができます。植え込み手技も10分程度で終了し、サイズも小さいので術後も目立たなくMRIも対応可能です。
植え込みの適応としては、原因が特定できない失神や潜因性脳梗塞における心房細動の評価とされます。
失神や脳梗塞の原因として不整脈が検出されれば不整脈のデバイス治療やカテーテルアブレーション治療が可能となります。
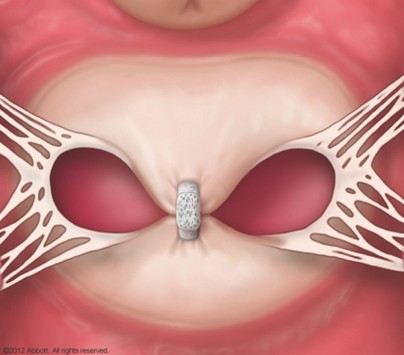
僧帽弁閉鎖不全症(MR)は、弁がきちんと閉じずに血液が左心房へ逆流する病気です。放置すると心不全や不整脈(心房細動など)の原因となり、入院や生命予後に影響することが知られています。
こんな症状は要注意:階段での息切れ、横になると苦しい、足のむくみ・体重増加、動悸・脈が乱れる など。
これまで重症MRの根本治療は外科手術(弁形成/弁置換)が中心でしたが、ご高齢の方や合併症のある方では手術リスクが高くなる場合があります。
M-TEER(経カテーテル僧帽弁接合不全修復術)は、足の付け根などからカテーテルを入れ、MitraClip®という小さなクリップで僧帽弁の一部をとめて逆流を減らす体への負担が少ない治療です。国際的な臨床研究では、適切な患者さんで心不全による入院や死亡のリスク低下が示されています。
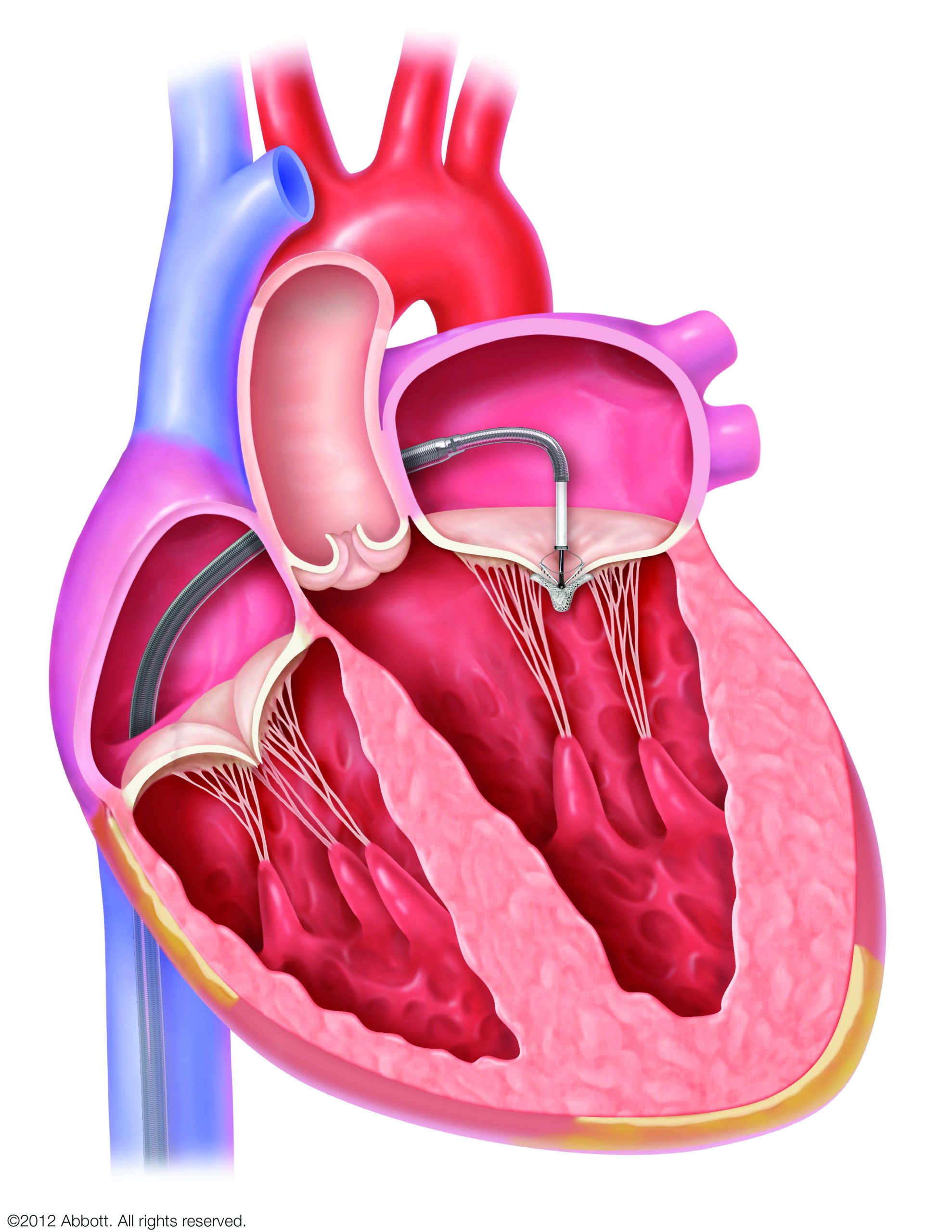
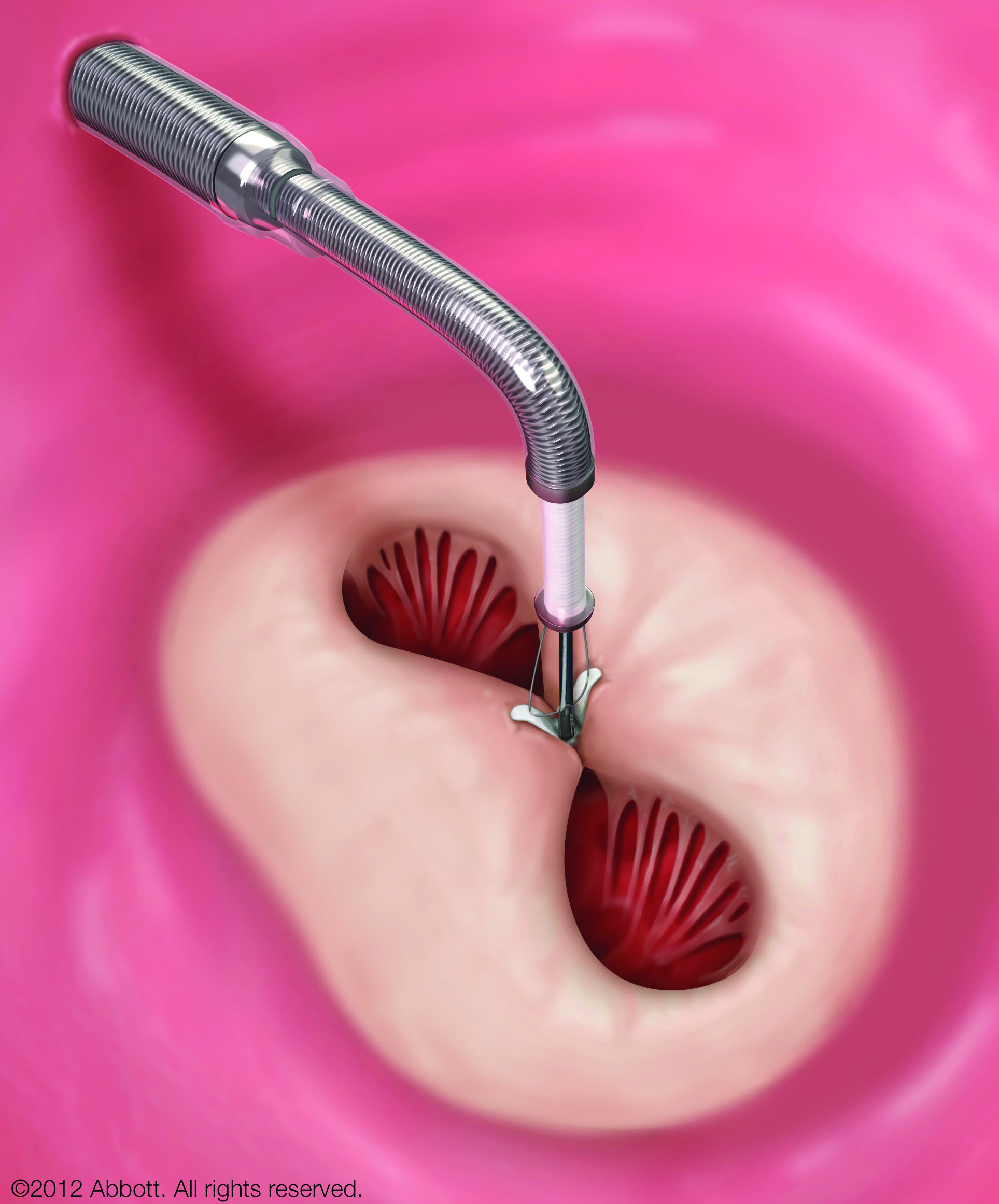
※ すべての方に適応となるわけではありません。当院ではハートチーム(循環器内科・心臓外科・麻酔科・画像診断科)で治療適応について慎重に判断しています。
→ 心エコー・CTなどの画像評価で詳しく判定します。


PFAは、心筋だけに選択的に作用する電気パルスで心房細動の原因部位(肺静脈)を治療する非熱(熱を使わない)アブレーションです。2024年に日本で承認され、国内でも使用が広がっています。
ランダム化試験や臨床研究で、PFAは従来の熱エネルギー法に比べ手技時間が短いことが示されています。
食道損傷・肺静脈狭窄・横隔神経麻痺など、周辺臓器のダメージが少ない傾向が多数の研究で示されています
動悸は「その時」に不整脈が起きていなければ、原因がわかりません。つまり、これまでの24時間の記録では見つからないことがあります。7日間の連続記録にすることで、一過性の発作性不整脈(心房細動・上室性/心室性期外収縮など)の検出率が上がることが報告されています。症状が毎日起きる方は24時間Holter心電図、数日に1回の方は7日間のHolter心電図をおすすめしています。
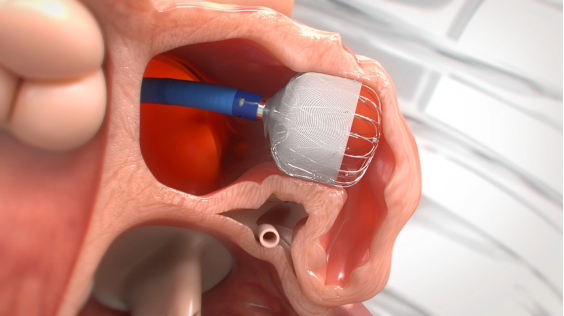
心房細動では、心臓の“袋”である左心耳に血栓(血の固まり)ができ、脳梗塞の原因になります。
左心耳閉鎖術(LAAC)は、カテーテルで左心耳の入口を栓(デバイス)でふさぎ、血栓が血管へ流れるのを防ぐ予防治療です。海外・国内の臨床研究で、抗凝固薬(ワルファリン/DOAC)と同等の脳梗塞予防効果が示され、出血合併症の低減などの利点も報告されています。
当院でも、循環器内科で実施しています。「抗凝固薬が続けにくい」患者さんの新しい選択肢です。
“© 20XX Boston Scientific Corporation. All rights reserved.”